B2.3. Configuración y funcionamiento (3)
Se ha realizado la adaptación de microorganismos a 10g/L de la fracción no metálica de PCB a los microorganismos Acidithiobacillus ferroxidans, en el medio 882.
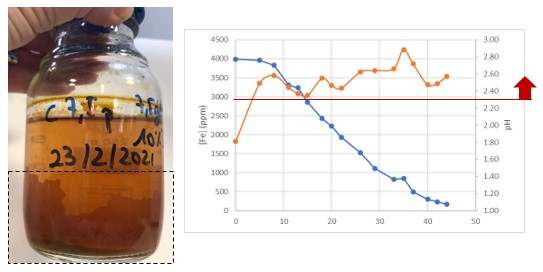
Se ha observado una formación de precipitado en las paredes de los botes, que muestran la formación de jarosita, un compuesto formado por hierro, cuando el pH es superior a 2,3. Al precipitar el hierro, se reduce la concentración de hierro en el medio, necesaria para el metabolismo de los microorganismos, y, por lo tanto, se reduce el rendimiento de los mismos para la biolixiviación de metales.
Tras las pruebas realizadas se concluye que el control de pH a 2 produce una mejora en el rendimiento, al evitar la precipitación del hierro, y que no es necesario añadir mayor cantidad de hierro al medio, puesto que no se ha detectado influencia notable en el resultado en las pruebas realizadas.
Se han probado diferentes pasos de adaptación, con mayor y menor numero de pasos, y los resultados muestran que las condiciones intermedias son las más óptimas para la adaptación de estos microorganismos a este tipo de residuo.
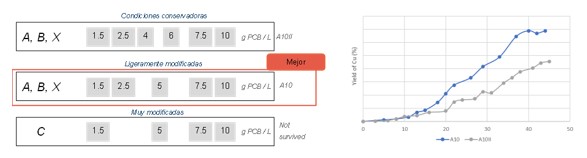
Con esas condiciones óptimas, se han adaptado los microrganismos a 10 g /L de fracción no metálica de PCB, y se ha procedido a adaptarlos con esa proporción S/L a mayor volumen, hasta alcanzar los 50L necesarios para los test en el equipo piloto.
Se han realizado test en 50 L, en los que se han mantenido control de temperatura a 30ºC, ph constante a 2, y se han realizado mediciones regulares del contenido metálico en el líquido, mediante toma de muestra y análisis en el ICP-OES. Los metales a los cuales se ha realizado seguimiento son Al, Cr, Fe, Ni, Cu, Zn, Ag, Sn, Au y Pb.
Se ha observado un cambio de color en el medio, entre el inicio y el fin de cada experimento, que puede observarse en la figura.

Se han realizado tres experimentos en 50L, y las principales conclusiones extraídas son las siguientes:
- Analizando los resultados de los metales presentes en una cantidad mayor del 6% en el residuo, se obtiene una extracción de cobre media del 90%, que incluso en algunos casos supera el 94%. Para el caso del Aluminio, la eficiencia alcanza valores del 80%.
- En el caso de los metales con menor presencia en el residuo (<1%), el Níquel y el Zinc muestran valores de extracción del 56 y 84 % respectivamente, por lo que se estima que estos microorganismos podrían utilizarse para extraer estos metales de otros residuos que los contengan en mayor concentración.
- No se detecta la lixiviación de oro del residuo, y la extracción de plata es menor del 4% en todos los casos. Se concluye que es necesario otro tipo de microorganismos para extraer estos metales, pero, además, su baja concentración en el residuo dificulta su recuperación con este método.
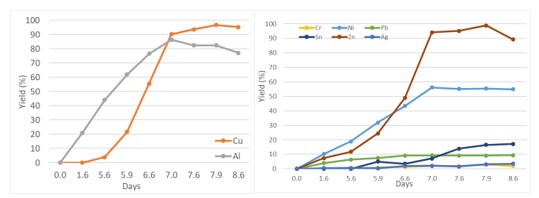
Figura. Resultados obtenidos en uno de los experimentos.
B3.2. Análisis de rentabilidad, continuación y replicabilidad del proyecto (1)
Con base en el conocimiento desarrollado durante la implementación de tareas anteriores, se está evaluando la transferibilidad de esta tecnología para la aplicación a otros residuos. En particular, el polvo recuperado del sistema de aspiración en el tratamiento mecánico de RAEE ha sido seleccionado para ensayos experimentales con biolixiviación, debido a que este polvo es un residuo con alto contenido en Cu, y otros metales, pero con opciones de tratamiento limitadas por su granulometría y características.
En particular, las pruebas definidas son:
- Biolixiviación en 2 etapas (etapa anaeróbica y aeróbica) aplicada al polvo recuperado del tratamiento mecánico de PCB.
- Evaluación del paso aeróbico con el polvo recuperado en el sistema de aspiración del tratamiento mecánico de RAEE, con mayor contenido en Cu.
B3.1. Extracción metálica de las disoluciones obtenidas tras la biolixiviación
Se ha realizado una revisión bibliográfica en profundidad de los procesos metalúrgicos para recuperar los metales estratégicos presentes en la disolución obtenida tras la biolixiviación. Entre varios métodos, se seleccionaron los más relevantes para los test: electrodeposición, precipitación y cementación.
- Cementación: es un tipo de precipitación en la que los iones se reducen a valencia cero en una interfaz metálica sólida.
- Precipitación: se diseñó un procedimiento secuencial para precipitar metales por separado. El precipitado resultante se filtra, se lava y se calcina. Se realiza una evaluación adicional del sólido resultante.
- Electrodeposición: se hace pasar una corriente eléctrica desde un ánodo inerte (oxidación) a través de una solución de lixiviación que contiene los iones metálicos disueltos para que el metal se recupere al depositarse en un proceso de galvanoplastia sobre el cátodo (reducción).

Figura. Equipo de electrodeposición usado en los test
B2.3. Configuración y funcionamiento (2)
Tras el proceso de adaptación, se han definido experimentos con el fin de incrementar el conocimiento de los parámetros óptimos para las pruebas en condiciones aeróbicas:
- Realizar el aumento progresivo de volumen en las pruebas, llegando a 50L.
- Aumento de la concentración de fracción rechazo de PCB del 1% al 10% en 250 mL (en curso).
- Tiempo esperado para obtener máxima lixiviación.
- Influencia de los pasos de adaptación hasta llegar a 10 g PCB / L.

Figura. Pruebas realizadas en condiciones aeróbicas y resultados esperados
En estas pruebas se ha demostrado que se evita la precipitación de jarosita al controlar el pH, minimizando las pérdidas de hierro en la disolución, aumentando el rendimiento y reduciendo también el tiempo de las pruebas. Se han iniciado pruebas con mejores condiciones, como se puede observar en la figura.

Figura. Evolución de los tests en el reactor de 50L.
Los resultados obtenidos están siendo evaluados, y se asegurará la repetición de los mismos con el objetivo de poder extraer conclusiones robustas de dichos tests.
B2.3. Configuración de trabajo con el piloto y escalado
Previo a la adaptación de los microrganismos se llevaron a cabo una serie de procesos para la adecuación de los medios de laboratorio a los procedimientos de trabajo en la biolixiviación:
- Desarrollo de protocolos de seguridad e higiene laboral
- Estudio de procesos de esterilización del medio y fungibles
- Estudio de los microorganismos presentes en las condiciones de reacción que puedan competir con los Acidithiobacillus ferroxidans.
- Tratamiento previo de limpieza de la fracción no metálica de PCB para la biolixiviación
- Testeos de funcionamiento de equipos durante el escalado (250 ml – 1 L – 10 L – 50 L)

Fracción no metálica de PCB tratada con NaCl saturado y posterior limpieza a fin de separar componentes potencialmente tóxicos
Proceso de adaptación y escalado de Acidithiobacillus ferroxidans la fracción no metálica obtenida tras el tratamiento mecánico de los PCB:
El proceso de escalado consta de 6 etapas:
- Etapa 1: Inoculación de viales
- Etapa 2: Adaptación a 250 ml
- Etapa 3: Adaptación con PCB a 250 ml
- Etapa 4: Adaptación a con PCB a 1 L
- Etapa 5: Adaptación a con PCB a 10 L
- Etapa 6: Adaptación a con PCB a 50 L
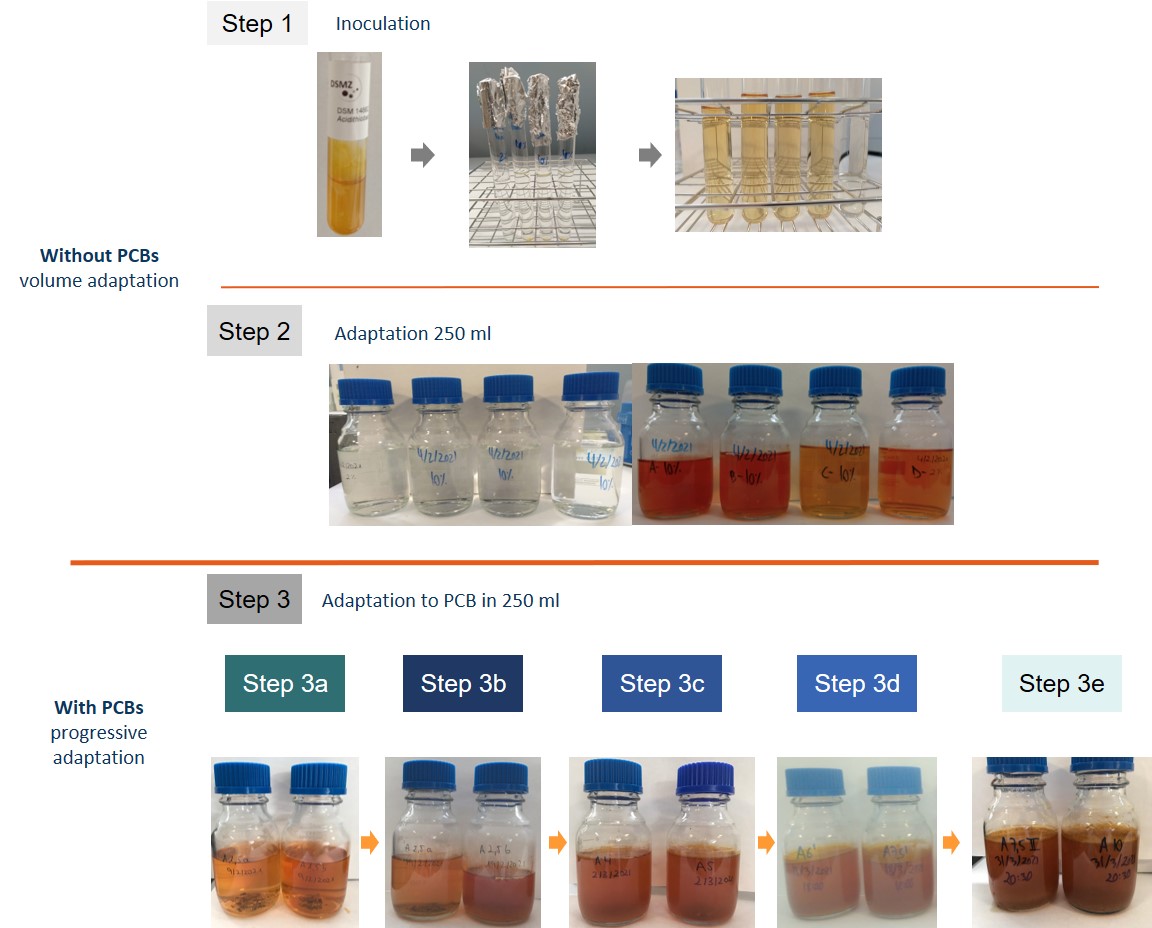
Etapas1-3 del proceso de adaptación y escalado.

Etapas 4-6 del proceso de adaptación y escalado.
B2.2. Construcción e instalación piloto (3)
En base a las pruebas realizadas con el reactor de 10L, propiedad de INATEC, que estaba equipado con sensores y agitación, se concluyó que era necesario comprar un nuevo reactor de dicha capacidad, pero encamisado, y un sistema de control de temperatura, con el fin de mejorar el control de temperatura en los experimentos a este volumen.

Figura. Reactor de 10 L y enfriador para el proceso de adaptación
Adicionalmente, para evitar bloqueos en la descarga del residuo de PCB, también se ha incluido en el diseño un sistema específico para abrir el reactor.

Figura. Boquilla de descarga específica para evitar bloqueos en el reactor de 10 L
B2.2. Construcción del piloto e instalación
Se ha llevado a cabo la construcción de un prototipo de 50 L para las operaciones de biolixiviación de la fracción no metálica de los PCB tras el tratamiento mecánico mediante los microrganismos Acidithiobacillus ferroxidans.

Prototipo de 50 L construido para el proyecto BIOTAWEE
El prototipo consta del siguiente equipamiento para controlar las condiciones de operación durante la biolixiviación:
- Analizador de pH que facilitará tanto la supervisión de la evolución del pH de la reacción como un posible control a pH constante.
- Controlador de la agitación + varilla con aireación para una agitación controlada que no entorpezca la evolución de los microorganismos y que incorpora aireación en la varilla para mejorar la recirculación del aire en beneficio de las reacciones aerobias que tienen lugar.
- Controlador de T que nos permite un control preciso lo cual es de gran importancia para las reacciones y supervivencia de los microorganismos.
B2.2. Construcción del piloto e instalación
Se ha realizado el diseño de la tecnología necesaria para reproducir el proceso, aumentando la escala hasta una capacidad de 50L. Se ha contactado a los proveedores y la revisión de las ofertas está casi completa.
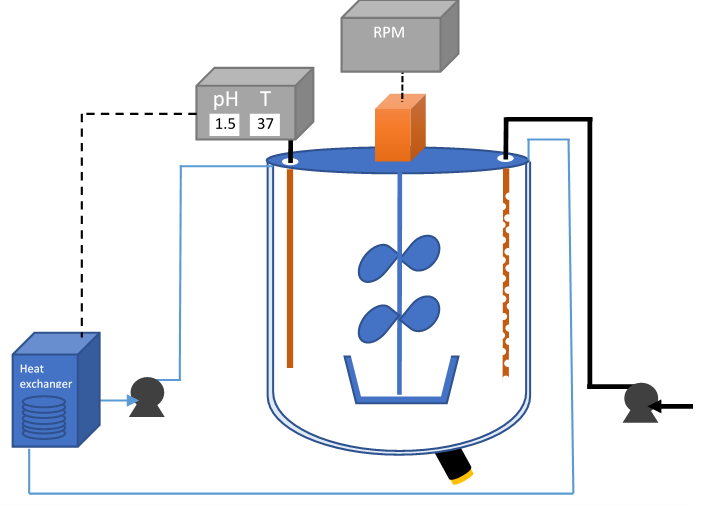
Tecnología diseñada para el reactor de 50 L.
Mientras tanto, se ha realizado la revisión del material de laboratorio necesario para la prueba. Antes de iniciar la prueba en un reactor de 50L, los microorganismos tienen que adaptarse previamente al PCB en matraces de 250ml, aumentando el volumen progresivamente, siendo el volumen previo al reactor de 50L un reactor de 10L ya propiedad de INATEC. Este reactor, equipado con sensores y agitación, ha sido revisado y ya se ha encargado todos los reactivos y material necesario para trabajar con los microorganismos.

Prueba realizada en el reactor de 10 L para comprobar el rendimiento.
B2.1. Obtención y preparación de muestras.
El procesamiento ejecutado con los PCB incluye varias etapas de trituración y separación hasta la obtención de una fracción no metálica para probar mediante tecnología de biolixiviación. La siguiente figura muestra los tres pasos globales del proceso por los cuales pasa el material hasta conseguir la fracción final:

Los PCB a través de los procesos de trituración y separación.
1er PASO: El proceso comienza con la trituración del material en una fragmentadora.
2o PASO: El material se introduce en el molino durante varios ciclos.
3er PASO: El objetivo de este paso es separar la fracción metálica de la no metálica.
MATERIAL PARA BIOLIXIVIZACIÓN: La fracción no metálica obtenida en el paso anterior es la seleccionada para ser utilizada en el proceso de biolixiviación que llevará a cabo el consorcio BIOTAWEE.
B1.3. Ensayos de laboratorio a 20 l que combinan el proceso de biolixiviación en 2 pasos
Los reactores a escala de laboratorio están equipados con todos los sensores, puertos de muestreo, agitadores y módulo de control necesarios para probar el proceso a mayor escala.
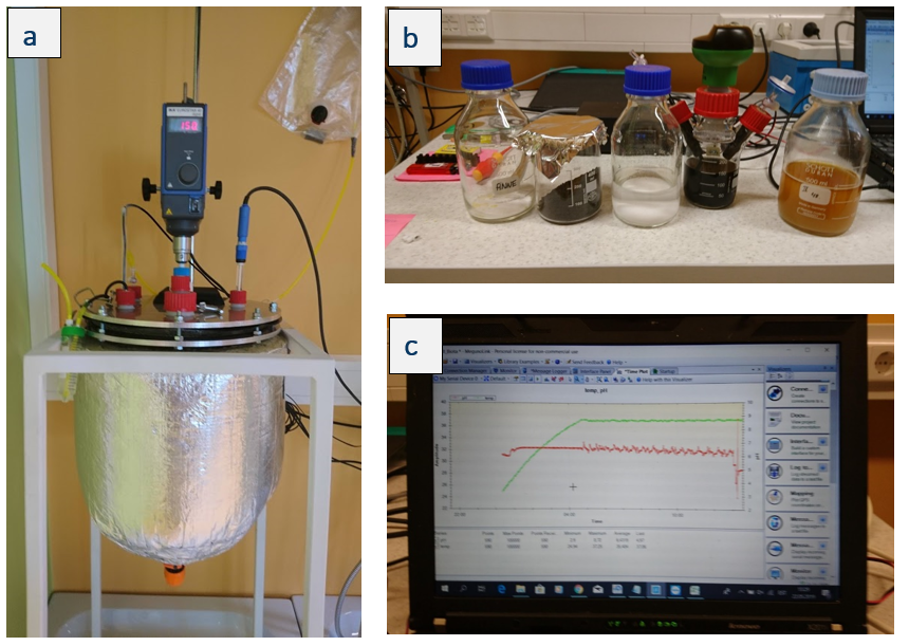
Figura. A. El reactor de vidrio de 20 L con sensores, agitador, puertos de muestreo y unidad de control; B. Los componentes de los medios de cultivo, el material mineral y el inóculo ARGCON5 preparados para un experimento a escala de laboratorio (20L); C. Interfaz informática del módulo de control.
La información básica del experimento de 20 litros es similar a la obtenida a escala de laboratorio (250 ml):
- La extracción de Cu usando el proceso anaeróbico-aeróbico de 2 pasos fue casi dos veces más eficiente que usando el proceso aeróbico solamente (28,02% vs 13,58% rendimiento de lixiviación de Cu).
- Se observó extracción moderada de Pt (eficiencia 5.6%) en el paso anaeróbico.
- No se liberaron Au-Ag en aeróbicos ni en el proceso aeróbico-anaeróbico de 2 pasos.
- Dado que el valor principal del paso anaeróbico es la generación de biogás, se debe prestar atención a la elección adecuada de la viabilidad y concentración del inóculo.
El pH es un parámetro importante para seguir la cinética del proceso de biolixiviación y un indicador confiable sobre la posibilidad de generación de metano.
B1.2. Experimentos realizados en el paso aeróbico
Se realizaron experimentos de cultivo aeróbico con Acidithiobacillus ferrooxidans DSM14882 con residuo resultante del tratamiento del residuo de circuitos impresos de RAEEs mediante la fase anaeróbica, en matraces de agitación de 250 mL, incluyendo aireación en un agitador simulando la fase aeróbica del proceso de biolixiviación.
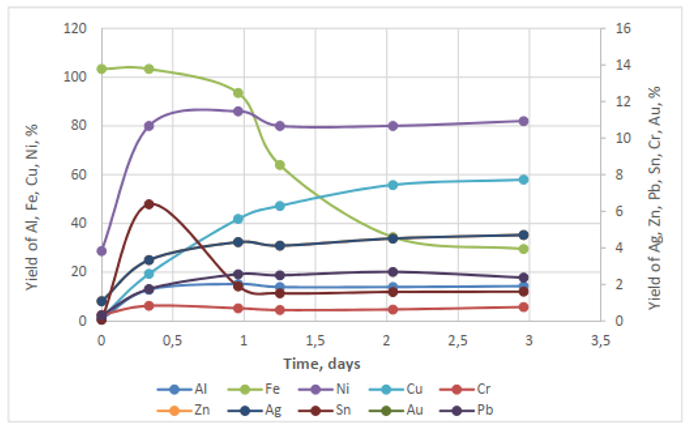
Figura. Fase aeróbica. Separación de metales en suspensiones de PCB, provenientes del tratamiento anaerobico, con Acidithiobacillus ferroxidans
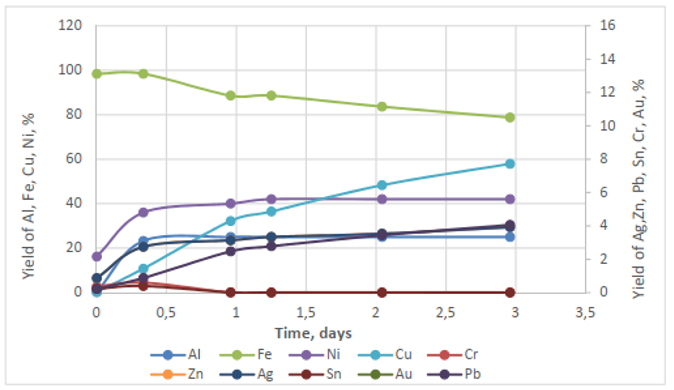
Figura. Fase aeróbica. Separación de metales en suspensiones de circuitos impresos sin tratamiento previo, con Acidithiobacillus ferroxidans
En 48 horas se obtuvo una liberación de 100% Fe, 80% Ni y 60% Cu a partir de los residuos de circuitos impresos de RAEE previamente tratados mediante la fase anaerobia. La eficacia de la lixiviación es casi la misma que con los circuitos impresos de RAEE sin tratar, excepto en el caso del Ni.
B1.1. Experimentos realizados en el paso anaeróbico
Se han realizado experimentos para comparar la lixiviación de metales en las siguientes condiciones:
- con inóculo ARGCON5 (inóculo 5A) vs inóculo 32 (comunidad adaptada a residuos electrónicos);
- con medio (+ inóculo) vs suspensión de residuos electrónicos (+ inóculo);
- con solución de residuos electrónicos (+ inóculo) vs suspensión de residuos electrónicos (sin inóculo);
- con medio de cultivo (medio R2A y vinaza) vs agua esterilizada;
- compara los diferentes componentes de los medios: betaína frente a vinaza
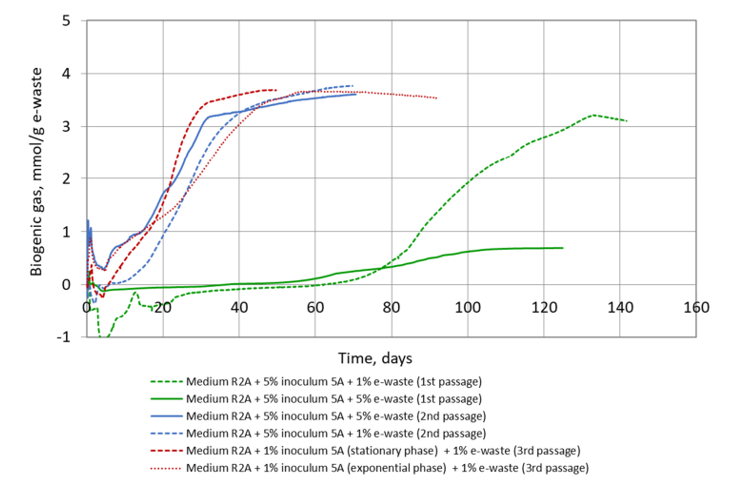
Figura. Cambios en el rendimiento de gas biogénico en microcosmos con muestras de PCB de RAEE, T = 37ºC, inóculo ARGCON5 (inóculo 5A), 1% y 5% de sustrato, normalizado al inóculo.
Se obtuvo que, con varios pases a medio fresco (evolución adaptativa de laboratorio), se mejoró la producción de biogás y la capacidad de lixiviación de metales.
A1.4. Análisis del contenido metálico, numero de microorganismos y pH
Se tomaron muestras de los medios de cultivo de ARGCON5 (anaerobio) con suspensiones de la fracción rechazo del tratamiento mecánico de circuitos impresos en los matraces para determinar en la fase líquida el contenido de metales mediante el método ICP-MS. Los rendimientos iniciales de metales fueron moderados ya que los microorganismos aún no se han adaptado al material. En los mismos días, se tomaron muestras de los medios de cultivo para el recuento e identificación de microorganismos. Las muestras se centrifugaron (5000 rpm, 10 min) para separar la biomasa de microorganismos, de los que a su vez se aisló el ADN.
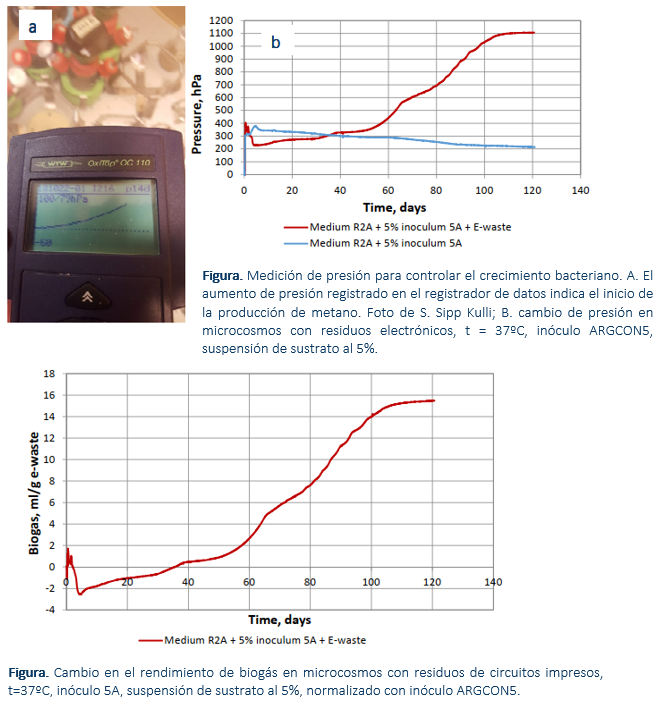
El enriquecimiento del consorcio microbiano a partir de los residuos electrónicos (circuitos impresos) fue un éxito ya que el número de microorganismos al final del experimento fue comparativamente alto (107 UFC / ml). El pH del medio de cultivo estaba en el rango que facilitaba el crecimiento de metanógenos; sin embargo, varios metales se encuentran en forma de compuestos insolubles a este pH (pH 8,5), siendo la mayoría de los metales lixiviados en la segunda fase acidófila (aeróbica).
En la actividad actual se demostró la aplicabilidad del consorcio ARGCON5 para el uso con circuitos impresos extraídos de RAEE. Fue posible enriquecer una comunidad microbiana productora de metano a partir de los mismos. Aunque el rendimiento inicial de metano y la capacidad de extracción de metales fueron modestos, se pueden intentar optimizar modificando el medio y mediante la evolución adaptativa del laboratorio (Acción B1).
A1.2. Estudio del potencial de biodegradación microbiana de especies indígenas de ARGCON5 con experimentos de cultivo de biolixiviación en microcosmos con el sistema de medición OxiTop AN.
Matraces del sistema de medición OxiTop AN que contienen PCBs de WEEE en el medio de crecimiento inoculados con ARGCON5 y el medio de crecimiento e inóculo tras 100 días de experimento. El matraz con PCBs de WEEE es notablemente más oscuro.
Foto de A. Menert.
Matraces del sistema de medición OxiTop AN que contienen PCB de WEEE en medio de crecimiento inoculado con ARGCON5 adaptado a los desechos electrónicos, con medio de crecimiento e inóculo solamente y con PCB de WEEE en medio de crecimiento (sin inóculo), en 10 días del experimento. En el matraz con todos los componentes agregados, las burbujas de gas indican la degradación de la materia orgánica.
Foto de A. Menert.
Matraces del sistema de medición OxiTop AN con PCB de WEEE en agua destilada. La fase líquida es cristalina sin la turbidez típica del crecimiento bacteriano.
Foto de A. Menert.
A1.1. Preparación del inóculo para los experimentos de cultivo de biolixiviación.
El inóculo CELMS No EEUT ARGCON5 se cultiva en tubos de ensayo en un agitador termostatizado a t = 37 °C previo a su introducción en el experimento de bioilixiviación.
Foto de S. Sipp Kulli.
Trás el pre-cultivo, queda demostrado el crecimiento de bacterias dad la notable turbiedad en los tubos de ensayo con el inóculo.
Foto de S. Sipp Kulli
Los colaboradores de BiotaTec Kärt Ukkivi, MSc y Anne Menert, PhD están examinando la calidad del inóculo CELMS No EEUT ARGCON5. El inóculo ha crecido y está listo para ser agregado a la fracción no metálica de PCB de WEEE.
Foto de S. Sipp Kulli.
© Copyright 2019 - Designed by COASER IT












